جوایز لاسکر از سال ۱۹۴۶ سالانه به افراد زندهای که مشارکتهای عمدهای به علم پزشکی کردهاند یا در حوزه پزشکی خدمات عمومی عمدهای انجام دادهاند، اهدا میشود.
این جوایز را بنیاد لاسکر اهدا میکند که بوسیله آلبرت لاسکر و همسر ش مری وودارد لاسکر در سال ۱۹۴۲ پایهگذاری شد.
لبرت لاسکر یک مدیر تبلیغاتی بود که در سال 1952 درگذشت. همسر او، مری، پیش از مرگش در سال 1994 یکی از فعالان مداوم در زمینه پژوهش پزشکی بدل بود. این جوایز که گاهی به آن نوبلهای آمریکا میگویند، در هریک از ردههایش ۲۵۰ هزار دلار ارزش دارند.
چهار رده عمده این جوایز اینها هستند:
- جایزه پژوهش پایه پزشکی آلبرت لاسکر
- جایزه پژوهش پزشکی بالینی لاسکر- دوبکی
- جایزه خدمات عمومی لاسکر- بلومبرگ
- جایزه دستاورد ویژه در علوم پزشکی لاسکر- کاشلند
امسال پنج نفر از پژوهشگران به خاطر پژوهشهایشان در درمان پارکینسون، شناخت مکانیسمهای پیچخوردگی پروتئین در سلولها و کشف ژن سرطان پستان برنده جوایز بنیاد لاسکر شدند.
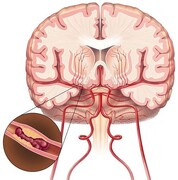
پژوهشها برای یافتن درمانی برای موارد سخت پارکینسون از اواخر دهه ۱۹۸۰ آغاز شد هنگامی که آلیم لوئي بنابید (Alim Louis Benabid)، جراح اعصاب در گرنوبل فرانسه تصمیم گرفت یک جریان الکتریکی پرفرکانس را به درون مغز یک بیمار بفرستد.

درمان استاندارد و کاملا موثر پارکینسون، در آن زمان- و هنوز تا به امروز- داروی لوودوپا، پیشساز ناقل عصبی دوپامین است که بیماران پارکینسون دچار کمبود آن هستند. اما همه بیماران به خوبی به لوودوپا پاسخ نمیدهند، پس از استفاده درازمدت اثر سودمند این دارو نهایتا از دست میرود.
سختترین موارد پارکینسون در حال حاضر به همان شیوهای معمول از دهه ۱۹۴۰، با استفاده از جراحی برای تخریب یا ایجاد ضایعه در نواحی از مغز برای متوقف کردن لرزش درمان میشوند. بنابید مایوسانه به دنبال گزینه دیگری برای درمان پارکینسون بود. او میگوید: «این مشکل همه ذهنم را اشغال کردم. مداوما به آن فکر میکردم. چطور میتوان درمان بهتری انجام داد؟»
بنابید در سال ۱۹۸۷ آماده میشد که برای درمان یک بیمار مبتلا به ترمور اولیه، اختلالی که علائم مشابهی با پارکینسون دارد، بخشی از مغز او را تخریب کند. او پیش از ایجاد ضایعه برای آزمایش اینکه منطقه درستی از مغزی را انتخاب کرده است، یک پروب الکتریکی در مغز قرار داد تا با جریان خفیف الکتریکی مغز بیمار را تحریک کند. بیمار در جریان این عمل بیدار نگه داشته میشد تا جراج بتواند عوارض ناخواسته را دریابد.
بنابید میگوید از آنجایی که در ابتدا فیزیک خوانده بود، همیشه به پارامترهای تحریک الکتریکی علاقه داشت. هیچکس توجه زیادی به فرکانس جریان نکرده بود و همه از فرکانس استاندارد ۵۰ هرتز استفاده کرده بودند، اما او کنجکاو بود که بداند اثر فرکانسهای متفاوت جریان الکتریکی بر مغز چیست. بنابراین او از بیمارش خواست که یک تجربه کوچک بر روی او انجام دهد. او با فرکانس یک هرتز شروع کرد، و به تدریج آن را تا ۱۰۰ هرتز بالا برد. در فرکانسهای پایین هیچ اتفاقی رخ نداد. اما در بالای ۸۰ هرتز، بیمار به طور ناگهانی ساکن شد و لرزشش قطع شد. بنابید که فکر میکیرد بیمار دچار انقباض گسترده عضلانی شده است، جریان را قطع کرد و از بیمار پوزش خواست. اما بیمار گفت دلیلی برای عذرخواهی وجود ندارد- او دچار حمله تشنجی نشده بود- بلکه لرزشش متوقف شده بود. بنابید میگوید: «در این هنگام پیبردم که راه حلی را که به دنبالش میگشتم، پیدا کردهام.»
تقریبا در همان زمان، مالون دلونگ، دانشمند علوم اعصاب در دانشگاه اموری در جرجیای آتلانتا در حال سا ختن مدلی مشروح از مدارهای مغزی بود که حرکات بدن را هدایت میکنند. دلونگ قبلا مدارهای عصبی مربوط به حرکت را در ناحیهای از مغز به نام عقدهههای پایهای (basal ganglia) نقشهبرداری کرده بود، و شروع به کاوش درباره این موضوع کرده بود که چه نقائصی در این سیستم میتواند به بیماری پارکینسون و سایر اختلالات حرکتی بینجامد.
ختن مدلی مشروح از مدارهای مغزی بود که حرکات بدن را هدایت میکنند. دلونگ قبلا مدارهای عصبی مربوط به حرکت را در ناحیهای از مغز به نام عقدهههای پایهای (basal ganglia) نقشهبرداری کرده بود، و شروع به کاوش درباره این موضوع کرده بود که چه نقائصی در این سیستم میتواند به بیماری پارکینسون و سایر اختلالات حرکتی بینجامد.
در دهه ۱۹۸۰ شیوع ناگهانی علائم شبیه پارکینسون در میان معتادان مواد مخدر در کالیفرنیا بروز کرده بود. بعدها معلوم شد که این علائم ناشی از یک شیمیایی به نام MTMP - یک سم با اثر انتخابی بر نورونهای دوپامینی- است که برخی از بستههای هروئین صناعی را آلوده کرده است. هنگامی که MTMP به میمونها داده شد، باعث ایجاد علائم پارکینسون در آنها شد، و به این ترتیب مدلی جدید برای بررسی این بیمار در دسترس قرار گرفت.
دلونگ بر هسته زیرتالاموسی، بخشی از عقدههای پایه، متمرکز شد که پیامهای محدودکننده برای مهار سایر بخشهای سیستم حرکتی میفرستند. او نشان داد که MTMP باعث میشود که هسته زیرتالاموسی در میمونها به طور کنترلناپذیری فعال شود و پیام بفرستد- و مهمتر اینکه با غیرفعال کردن این نورونها میتوان این علائم را متوقف کرد.
دلونگ میگوید، مشکل این بود «که هیچکس که عقلش درست کار کند حاضر نیست در این منطقه مغز جراحی انجام دهد.»
اما تکنیک تحریک عمقی مغز بنابید بازگشتپذیر بود- و به این علت درمان ایدئالی برای هدف قرار دادن نواحی حساسی بود که دلونگ نقشهبرداریشان کرده بود.
دلونگ و بنابید به علت همین پژوهشها که به ایجاد درمانی موثر برای بیش از ۱۰۰ هزار نفر در سراسر دنیا که مبتلا به پارکینسون و سایر بیماری انجامید، روز جمعه ۱۲ سپتامبر به طور مشترک برنده جایزه پژوهش پزشکی بالینی لاسکر- دوبکی ۲۰۱۴ شدند.
هلن میبرگ، نورولوژیست دانشگاه اموری، میگوید کار این دو نفر تاثیر بزرگی در حوزههایی فراتر زا بررسی و درمان بیماری پارکینسون داشته است. نقشههای دلونگ اساس مدلی را برای اغلب پژوهشها در روانپزشکی امروز را تشکیل میدهند، و بنابید عصر مدرن بررسی عقلانی و با اساس علمی تحریک عمقی مغز را آغاز کرد که اکنون برای درمان بسیاری از اختلالات نورولوژیک دیگر هم به کار میرود.
او میگوید: «این دو نفر استانداردی برای هر کاری که هر کسی ممکن است در آینده در این زمینه انجام دهد، ایجاد کردند.»
از جمله کارهایی که در آینده باید انجام شود معلوم کردن شیوه دقیق تاثیرگذاری تحریک عمقی مغز است. مکانیسم واقعی که با آن جریان الکتریکی میتواند پیامهای صادرشده از نورونهای بیشفعال را مهار کند، هنوز دقیقا روشن نیست، و پژوهش در این باره ادامه دارد.
اسرار پیچخوردگی

جایزه پژوهش پایه پزشکی آلبرت لاسکی ۲۰۱۴ نیز به طور مشترک به دو پژوهشگر داده شد. اما کازاتوشی موری (Kazutoshi Mori)و پیتر والتر(Peter Walter) ، برخلاف دلونگ و بنابید که کارشان بر روی جنبههای متفاوت پارکینسون مکمل یکدیگر بود، رقبای مستقیم و خستگیناپذیر یکدیگر در شناخت راههای پیچیده ارتباط بخشهای یک سلول در مواجهه با پروتئینهای با پیچخوردگی نادرست است که به آن «پاسخ پروتئین پیچنخورده» (UPR) میگویند.
بسیاری از پروتئینها در سلول در «رتیکولوم آندوپلاسمیک» (ER) - شبکهای از لولههای و کیسههای محصور در غشا - ساخته میشوند که درون سیتوپلاسم سلول روی هم حلقه زدهآند. یکی از کارهای این اندامک سلولی کنترل کیفیت است و هنگامی که اسیب میبیند یا پروتئینهای با پیچخوردگی نادرست تجمع مییابند، برای به هسته پیام میفرستد تا کمک بفرستد و این کمک به شکل پروتئینهایی هستند که میتوانند به سایر پروتئینها کمک کنند تا به درستی روی خودشان پیچ بخورند.
والتر در میانه دهه ۱۹۹۰ در دانشگاه کالیفرنیای سانفرانسیسکو در کالیفرنیای آمریکا و موری در دانشگاه کیوتو در ژاپن چگونگی عمل این سیستم در مخمر را ردیابی کردند. پروتئینی به نام Ire1 در طول غشای ER قرار میگیرد- انتهای درون ER آن پروتئینهای پیچنخورده یا بدپیچخورده شناسایی میکند و انتهای سیتوپلاسمی آن با تغییر دادن mRNA پروتئینی دیگر به نام Hac1 به هسته پیام میفرستد.
هنگامی که mRNA تغییریافته به صورت Hac1 فعال ترجمه میشود، این پروتئین به هسته سفر میکندن و در آنجا ژنی را فعال میکند پروتئین دیگری به نام BIP را رمزبندی میکند و این پروتئین به پروتئینها کمک میکند تا به درست پیچ بخورند.
بعدها موری پروتئین دیگری را در پستانداران کشف کرد. این پروتئین به نام ATF6 در عرض غشای ER قرار میگیرد، و هنگامی که انتهای ER آن تجمع پروتئینهای پیچنخورده را شناسایی میکند، بخشی از خودش را آزاد میکند و این بخش به هسته میرود

و تولید پروتئینهای کمکی برای پیچخوردگی را تحریک میکند. یک راه سوم نیز در پستانداران کشف شده است: پروتئینی به نام PERK چنین تجمعی را شناسایی میکند، پروتئینی را فعال میکند که ترجمه mRNA را مهار میکند و باعث سبک کردن بار ER برای پیچاندن پروتئینها میشود.
موری میگوید رقابت میان این او و والترز باعث اکتشافات تازهای شد. او میگوید گرچه این رقابت اکنون تا حدی از تب و تاب افتاده است، اما: «رقابت شدید میان من و پیتر در دهه ۱۹۹۰ باعث پیشرفت بسیار سریع در این حوزه شد. ما به یکدیگر احترام میگذاریم و اکنون دوستان و همکاران خوبی هستیم.»
والتر هم با این حرف موافق است، و میگوید آنها هنوز یکدیگر را برمیانگیزند. او میگوید: «این تلاش موازی خوب است. هر کاری که ما انجام میدهیم بوسیله طرف دیگر آزمایش میشود.»
در حالیکه اسرار UPR فاش میشود، این اکتشافات ممکن است به درمانهایی برای بیماریهای متفاوت بینجامد. برای مثال سلولهای سرطانی در شرایطی زندگی میکنند که ممکن است به ایجاد شمار زیادی پروتئینهای با پیچخوردگی نادرست بینجامد- UPR آنها را زنده نگه میدارد. بنابراین یافتن راهی که این سازوکار را خاموش کند، ممکن است به نابودکردن تومورها کمک میکند. موری میگوید او به زودی غربالگری مواد شیمیایی که میتوانند UPR را در سلولهای سرطانی مهار کنند، خواهد پرداخت.
ابزارهای ژنتیکی برای حقوق بشر
ماری-کلر کینگ (Mary-Claire King) از دانشگاه واشنگتن در سیاتل آمریکا برنده امسال جایزه لاسکر- کاشلند برای دستاورد ویژه در علم پزشکی به خاطر کارش در حوزه ژنتیک شد، اما اگر او تحصیلش را با گرفتن لیسانس در آمار شروع نکرده بود، ممکن بود هیچگاه ژن BRCA1 را که با سرطان وراثتی پستان ارتباط دارد، کشف نکند.

کینگ در میانه دهه ۱۹۷۰ جستجو برای ژنی را آغاز کرد که میتوانست خطر سرطان پستان را افزایش دهد. گرچه از قبل معلوم شده بود سرطان در برخی از خانوادهها شایعتر است، معدودی از ژنتیکدانان تصور میکردند که بتوان ژن واحدی را یافت که مسئول این شیوع خانوادگی باشد- سرطان پستان بسیار شایع است، و آنقدر عوامل متفاوتی ممکن است در ایجاد آن دخیل باشند که موارد منفرد ژنتیکی بوسیله موارد نامربوط دفن میشوند. با این حال کینگ میدانست که این مشکلی آماری است- او فقط باید سیگنال را از نویز افتراق میداد.
رابرت واترسون، یکی از همکاران او در دانشگاه واشنگتن، میگوید بصیرت بزرگ او این بود که زنان دارای جهش ارثی در یک ژن ضروری احتمال در سنین پایینتر به سرطان دچار خواهند شد. کینگ با گرداوری دقیق خانوادههایی که در پایینترین سنین سرطان پستان در آنها بروز کرده بود توانست دامنه جستجویش را به یک بخش در کروموزوم ۱۷ محدود کند. مسابقهای برای جدا کردن این ژن به راه افتاده بود، اما متاسفانه کینگ با رقابت شرکت میریاد روبرو شد که پتنت این ژن را ثبت کرده بود( در ماه ژوئن ۲۰۱۳ این پتنتها بوسیله دیوان عالی معلق شد).
واتسون میگوید کار کینگ تاثیراتی در فراسوی سرطان پستان داشته است. او میگوید: «BRCA1 یکی از مثالهای اساسی است که نشان میدهد جهشهای DNA چقدر در سرطان مهم هستند.»
کینگ از تخصصش در ژنتیک برای خدمت به حقوق بشر استفاده کرد. او به در به هم رساندن خانوادههایی که بوسیله دیکتاتوری نظامی آرژانتین در دهه ۱۹۷۰ و ۱۹۸۰ یاری رساند، و پیشگام استفاده از تکنیکهای جدید با استفاده از DNA میتوکندریایی و بافت حفظ شده در دندان برای شناسایی اجساد افرادی که «ناپدید شده بودند» و برقراری پیوند میان اعضای جداشده خانوادهها بود.
کینگ از هنگامی که در اوائل دهه ۱۹۷۰ در شیلی زندگی و کار میکرد، در پیکارهای حقوق بشر فعال بود، و ژنتیک را ابزار مفید دیگری در مقابله دیکتاتوری میشمرد. او میگوید: «اگر ابزار خوبی داشته باشید، باید آن را به کار ببرید.»
از هنگامی که کینک همکاریاش با «مادربزرگان پلایا دو مایو» یک سازمان حقوق بشری که هدفش یافتن کودکان دزدیده شده و به طور غیرقانونی به فرزندیداده شده در دوران منازعات داخلی آرژانتین است- آغاز کرد تا به حال ۱۱۴ نفر را که در دوران کودکی از خانوادههایشان جدا شده بودند، تعیین هویت شده و به بستگانشان پیوستهاند.
کلر پومروی، رئیس بنیاد آلبرت و مری لاسکر، کینک و سایر برندگان را ستود: «برندگان امسال مظهر اعجاب و قدرت پژوهش پزشکی هستند. کارهایی ما در جوایز لاسکر ۲۰۱۴ از آنها تقدیر کردیم، بینشهایی بنیادی درباره چگونگی عمل بدن انسان فراهم میکنند، توانایی علم برای بهبود زندگیهای ما به تصویر میکشند و استفاده از تکنیکهای جدید برای پیشرفت پزشکی را برجسته میسازند.»
منبع :Lancet































نظر شما